

V této kapitole se zabýváme základy chemie, jejím názvoslovím, výstavbovými principy a základními výpočty nezbytné pro jakékoli další navazující studium chemie.
Nejprve je ale fajn si nadefinovat několik základních pojmů:
Prvek je látka tvořená ze stejných atomů (tedy například hromada diamantů)
Molekula je seskupení dvou a více atomů (třeba NaCl, kyselina sírová, ...)
Sloučenina je látka tvořená ze stejných molekul, lze ji popsat chemickým vzorcem (například papír)
Směs je něco co dostaneme, pokud smcháme dvě látky dohromady. Rozlišujeme směsi podle skupenství (pevé, kapalné a plyné), nebo podle homogenity, jako stejnorodé - homogenní, u kterých nerozlišíme jednotlivé složky (voda + líh), nebo jako nestejnorodé - heterogenní, u kterých rozlišíme jednotlivé složky (voda + písek, hrášek + kukuřice)
No a teď už dost toho zavádění pojmů a trochu teorie:
Chemie jako věda je závislá na poznání atomu. Pro začátek je vhodné si toto učivo 6. třídy zopakovat. Atom vypadá nějak takhle:
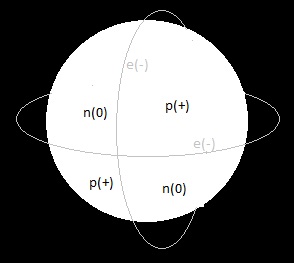
Ta velká koule uprostřed je jádro, kde je soustředěno cca. 99,8% celkové hmoty atomu. V jádře se nacházejí protony, které jsou nositelem kladných nábojů (p(+)) a podle jejichž počtu v jádře jsou atomy seřazeny v periodické soustavě prvků (PSP), kterou vytvořil pan Mendělejev na základě svých pozorování chování prvků a díky tomu byl schopný i docela přesně předpovědět existenci nových, v té době ještě neznámých prvků.
Dále máme v jádře neutrony, které nenesou náboj, ale ovlivňují jednak hmotnost atomu a druhak, a to především, stabilitu. Jak jistě víte např. z magnetismu, tak stejné póly se vždy odpuzují, stejně to platí i pro nabité částice. Dva protony vedle sebe nemužou být, protože se stejnou silou odpuzují a k tomu slouží ta kulička neutornu, která si mezi ně sedne a omezí ty odpudivé síly. Problém je v tom, že někdy, když je v jádře těch protonů hodně a neutronů relativně málo, se jim ty protony nedaří držet dost daleko od sebe, ty se od sebe odstřelí docela vysokou energií a jádro se následně rozpadne a uvolní se energie ve formě nějakého záření (zjednodušený princip jadené bomby). Chemika (tedy alespoň toho, který netouží zničit sebe a všechny v okolí) ale většinou neutrony nezajímají, takže je nyní přejdeme.
No a jako poslední tady máme ty čárky, které dohromady tvoří elektronový obal. Ty elektrony se ve skutečnosti po žádných čarách nepohybují... tedy ony se vlastně taknějak vůbec nepohybují, ony spíše skáčou mezi dimenzemi, jednou tu jsou, jednou ne, nikdo vlastně neví co a jak, proto tvrdíme, že elektrony se vyskytují (ne pohybují) ve slupkách. Tyto slupky - obaly mají různé tvary a jsou různě daleko od jádra a s tím jim také roste energie se kterou tam drží. Čím blíž jádru jsou, tím více jsou jím přitahovány. Je tedy jasné, že elektrony se budou nejdříve cpát nejblíže k jádru, dokud se nenaplní nějaká maximální kapacita "kastlíku" pro dané elektrony (viz níže).
Teď by bylo vhodné zase trošičku pojmy, ať jsme o něco chytřejší:
nuklid je hromádka atomů, které mají stejný počet protonů a neutronů (typicky třeba uhlík 12C)
izotop je hromádk atomů s různým počtem protonů a neutronů (například 235U)
Zmínil jsem tu PSP, kde se prvky řadí podle nějakých pravidel (ty se většinou učí až na VŠ). Ovšem každý prvek má své značení (a tím nemyslím alfabetickou zkratku), kterou by měl každý chemik znát. Většinou to vypadá nějak takhle:

kde A je chemický vzoreček, který vychází z latinského názvu (většinou první písmena) prvku a je jednoznačným identifikátorem. číslice b se používá, pokud mámě nějakou molekulu, ve které je daný prvek zastoupený vícekrát, nežli jednou. Označujeme jím poměr vůči ostatním přítomným prvkům (H2O = 2 vodíky na 1 kyslík). Číslo x se používá pro označní izotopu. Je to součet protonů a neutronů v jádře. Odečteme-li od čísla x číslo y, dostaneme počet neutronů, protože číslo y značí počet protonů v jádře a podle tohoto čísla jsou prvky v PSP řazeny. Nakonec je tu pak číslo z, které se používá pro vyjádření změny v elektronovém obalu. Říkáme tomu oxidační stav. Pokud tam žádné číslo není a jedná se o samotný prvek, pak je výchozí stav roven nule (1H0), jinak nabývá kladných hodnot (pokud od něj elektrony utekly), nebo záporných hodnot (pokud je někde ukradl).
Změny elektornů jsu to, co chemika zajímá nejvíce, neboť právě jejich přesuny jsou to, čemu běžné říkáme chemická reakce, ale než se dostaneme k nim, je třeba se do teorie elektronů zabrat hlouběji: Elektronové obaly