

= jedna z teorií vysvětlující tvar a prostorové uspořádání tří- a víceatomových molekul. Jedná se o to, že pokud se spolu hybridizují orbitaly různých typů, výsledkem je takový "patvar" oněch zúčastněných orbitalů. Vzájemná poloha je popisována jednak délkou vazby, kterou měříme v pikometrech (pm; 1 pm = 0,000 000 000 001 m) a torzními úhly, tedy úhly mezi spojnicemi jader atomů (jsou samozřejmě pomyslné, protože do jádra žádná "tyč" nezasahuje).
Hybridizují vždy různé typy orbitalů (ono kdž se spojí dva s orbitaly - dvě koule - tak co by na tom šlo také vymýšlet za složitosti). Nejtypičtějším typem hybridizace se kterým se setkáme je hybridizace typu spn, tedy křížení s a p orbitalu. Ukážeme si to názorně na příkladu uhlíkového atomu. Pokud si zakreslíme valenční vrstvu elektronovým zápisem, zjistíme, že [12C]: He, 2s2, 2p2. Tedy vidíme, že valenční vrstvy jsou ve stejné "slupce", tedy elektorny v nich mohou relativně snadno přebíhat mezi s a p orbitalem a to se také děje. Tomuto procesu se říká excitace a excitovaný uhlík značíme C*. Ukážeme si jak taková excitace vypadá zapsaná dle Hundova pravidla:
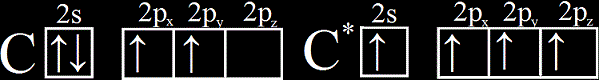
Vidíme, že došlo k přesunu jednoho elektronu a tím k uvolnění půlky nižšího orbitalu. Původní uhlík tedy mohl vytvořit 2 kovalentní vazby sdílením a zároveň mohl být akceptorem celého elektronového páru (měl na to místo), ale nový, excitovaný uhlík může vytvořit 4 kovalentní vazby sdílením dohromady 4 elektronů od 2 až 4 partnerů. Samozřejmě toto nemusí dělat jenom uhlík, umí to spousta jiných prvků (křemík) i iontů (třeba Fe3+). Tyto 4 vazby by ale byly nerovnocené, jedna by měla energii jinou, než ty zbývající a proto dochází právě k hybridizaci, která smazává energetický deficit mezi orbitaly a pokud se prvek spojí s maximálním možným počtem stejných partnerů, tak každá vazba bude mít stejnou energii (i délku vazby). hybridizovat musí jeden orbital typu s s minimálně jedním typu p, od kterého si energii převezme.
= křížení 1 orbitalu typu s a 3 orbitalů typu p. Výsledkem jsou 4 rovnocenné sigma vazby (nazýváme je jednoduché). Torzní úhel je 109,28° (prostorových!), v prostoru vypadá jako pravidelný čtyřstěn v jehož středu sedí právě uhlík a každá vazba trčí do jednoho vrcholu tohoto útvaru.
= křížení 1 orbitalu typu s a 2 orbitalů typu p. Výsledkem jsou 3 rovnocenné sigma vazby a 1 volná pí vazba, která se spojí s jinou volnou pí vazbou v rovině nad a pod některou sigma vazbou a vytvoří to, čemu říkáme dvojná vazba (nebo se spojit nemusí a prostě se nad a pod rovinou nachází taková elektronová kapka). Torzní úhel je 120°C (planárně), tedy vzniká jakýsi trojuhelník (může a nemusí být rovnostranný, zase podle toho, jestli na každé vazbě sedí stejný atom, nebo ne). Tento typ hybridizace se vyskytuje třeba u chloridu železitého, nebo mezi uhlíky v molekule etylénu (ethenu).
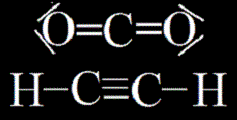
= křížení jednoho orbitalu typu s a 1 typu p. Vásledkem jsou 2 rovnocenné sigma vazby a 2 volné p orbitaly, jeden nad a pod spojnicí jader a druhý před a za spojnicí jader. tyto volné orbitaly se mohou spojit s jiným atomem hybridizovaným sp a vytvořit trojnou vazbu (sdílení 1 sigma a 2 pí vazeb), nebo z každé strany s jedním sp2 hybridizovaným atomem a vytvořit dvě dvojné vazby. První příklad je molekula acetylénu (ethynu), druhým příkladem je molekula oxidu uhličitého (CO2), torzní úhly jsou vždy 180°(všechny 3 atomy leží v přímce).
- Jak vidíte, tak čtverná vazba nemůže existovat mezi uhlíky, neboť by vyždovala takovou hybridizaci, ze které by vznikl hybridizovaný orbital a zůstaly by 3 nehybridizované orbitaly typu p, což není možné.
- Složitější typy křížení řeší modelovací metody využívající teorii VSEPR a MO-LCAO, které využívají i d- a f- orbitaly, které se účastní čtverných, paterných a šesterných vazeb (vyšší nejsou, nejvyšší, šesterná, objevena ve struktuře uranu a wolframu).