

Stejně jako v každém jiném oboru lidské činnosti je třeba znát pravidla jak komunikovat, tak i v chemii existuje sada pravidel, které chemik musí umět používat, aby věděl s čím pracuje a pokud to následně popisuje, tak aby to věděli i ti, co to po něm budou číst. Vzhledem k naší jazykové příslušnosti, bohužel, máme práci poněkud ztíženou, nicméně české názvosloví je na druhou stranu velice elegantní.
Před více než sto lety pan Vojtěch Šafařík vymyslel, že se bude pojmenovávat prvek ve sloučenině, nikoli jako v anglosaských zemích, kde jen vezmou název prvku a narvou za něj rovnou oxidační stav, ale krátkými příponami, které budou jasně definovat příslušný oxidační stav. Do dnešní doby se používá toto názvosloví 8 oxidačních stavů (existuje i teoretický devátý). Rozdělení je podle toho, zda se příslušný prvek vyskytuje jako kation, tedy nabtá částice, která má kladný náboj (elektrony ji chybí), nebo jako anion, tedy částice, která je záporně nabitá (a má elektronů více).
Ptáte se proč je oxidačních stavů jen 8? Jak již bylo psáno v kapitole o elektronech, tak konfigurace se dá určit pomocí nejbližšího nejnižšího vzácného plynu a to proto, že žádný prvek nemuže přibrat/vydat víc elektronů, než kolik mu stačí právě ke konfiguraci nějakého vzácného plynu. Většinou to ani tak daleko nezachází a kupříkladu d-prvky nemohou často ani dávat elektrony z jiné, než d- vrstvy.
Chemický vzoreček se sestává ze dvou částí, z kationtové části a aniontové části. V chemii po celém světě se vzoreček píše tak, že se nejdříve napíše kationtová část a poté aniontová část (Na má náboj kladný, Cl náboj záporný, vzoreček tedy bude NaCl). V čem se my od většiny světa lišíme je, že název skládáme přesně v opačném pořadí. Američan řekne natrium chloride (což přesně odpovídá NaCl), kdežto našinec řekne chlorid (anion) sodný (kation), což je přesně naopak.
A aby to nebylo tak jednoduché, používá se křížové pravidlo, tedy pokud máme anion A s oxidačním stavem -X a kation B s oxidačním stavem Y, tedy slučeninu BYA-X, pak vzoreček bude, BxAY, tedy oxidační stav jde křížem (proto křížové pravidlo) a stává se z něho počet opačného prvku. Ale aby to nebylo tak snadné, tak pokud lze číslo X a Y krátit tak, aby byl výsledek celé číslo, tak se to i udělá (viz dále).
A nyní tedy tabulka pojmenování příslušných oxidačních stavů:
| Oxidační stav (X) | Koncovka | Příklad anion-kation | vzorec | |
|---|---|---|---|---|
| Kationtu AX+ | Aniontové skupiny BX+On(2n-X)- | |||
| I | -ný | -nan | chlornan sodný | NaClO |
| II | -natý | -natan | olovntan vápenatý | CaPbO2 |
| III | -itý | -itan | boritan železitý | Fe(BO2)3 |
| IV | -ičitý | -ičitan | křemičitan siřičitý | S(SiO3)2 |
| V | -ečný (-ičný) | -ečnan (-ičnan) | bromičnan fosforečný | P(BrO3)5 |
| VI | -ový | -an | chroman sírový | S(CrO4)3 |
| VII | -istý | -istan | chloristan chromistý | Cr(ClO4)7 |
| VIII | -ičelý | -ičelan | osmičelan osmičelý | Os(OsO5)4 |
Ale pozor! Některé charakteristické skupiny mají vlastní specifické názvosloví, teda je třeba se to naučit nazpaměť
= sloučeniny, ve kterých má kyslík oxidační číslo -II (O-II)
Jak je vidět na obrázku vrpavo, tak oxidický kyslík má dvě "ručičky" kterými může "něco chytit",
a také dva volné elektronové páry. Pozor, molekula oxidu sestávajícího ze 3 a víc atomů NENÍ lineární! Prostorově se to staví do véčka, kde ve spodku je kyslík, dvě nožky jsou vazby (u vody třeba na vodík) a kolmo k této rovině jsou vespod dva volné páry.
příklad: K2O (oxid draselný), CO (oxid uhelnatý), Fe2O3 (oxid železitý), ...
= sloučeniny, ve kterých jsou dva kyslíky spojeny peroxidickou vazbou celá tato skupin má oxidační stav -II (O-II) 
Peroxidy jsou velice nestálé, sami degradují už za vysokých teplot, většinou na kyslík a další látky (peroxid vodíku na vodu),
využívají se v organické syntéze, nebo třeba jako desinfekce,zdroj čistých anorganických
meziproduktů, nebo jako oxidační činidla.
Příklad: peroxid vodíku (H2O2), peroxid barnatý (BaO2),...
= sloučeniny, ve kterých je dimerní kyslík v oxidačním stavu -I (O2-I)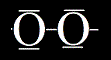
Supeoxidy obsahují dva kyslíky, z nichž jeden nese záporný náboj (má o elektron víc) a druhý nenese žádný náboj, ale má jeden nepárový elektron (radikál). Z tohoto důvodu jsou superoxidy velice nestabilní a jakmile se k nim přiblíží něco, co muže reagovat. tak to okamžitě reagovat bude.
Příklad:superoxid křemičitý (Si(O2))4, superoxi železitý Fe(O2)
Podobnými sloučeninami jsou ozonidy, které mají doprostředka vklíněný ještě jeden kyslík
= sloučeniny, ve kterých je kyslík jednou vazbou vázán na vodík (-OH)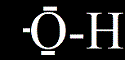
Jsou velice rozšířené, v organické chemii se jim říká alkoholy. Pozor! To že vypadají trošičku jako voda, neznamená že jsou všechny v té vodě rozustné!
Příklad:hydroxidy sodný (NaOH), hydroxid vápenatý (Ca(OH)2), hydroxid chromitý (Cr(OH)3),...
= sloučeniny, kde se halogen X vyskytuje v oxidačním stavu -I (X-I)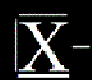
Když se koukneme do tabulky na předposlední sloupeček, uvidíme tam halogeny (F, Cl, Br,I, At), když jim přidáme jeden elektron, dostanou se na konfiguraci vzácného plynu, tedy jsou v tomto stavu velice stabilní a nemají moc důvodů to měnit.
Příklad: bromid sodný (NaBr), fluorid křemičitý (SiF4),...
= sloučeniny prvků I.A a II.A skupiny s vodíkem H-I
Všechny tyto sloučeniny jsou iontové a vysoce reaktivní i s vodou, používají se ke vnášení vodíku do molekuly (na redukci).
Příklad: hydrid lithný (LiH), hydrid hořečnatý (Mg(H)2),...
= sloučeniny s vodíkem v oxidačním stavu +I (H+I), který ale není snadno odštěpitelý a nemá tedy kyselý charakter
Tyto sloučeniny mají koncovku -an (krom těch, které mají vžité triviální názvy):
| III.A + H+ | IV.A + H+ | V.A + H+ | VI.A + H+ |
|---|---|---|---|
| BH3 (boran) | CH4 (methan) | NH3(amoniak) | H2O (voda) |
| AlH3 (allan) = hydrid! | SiH4 (sillan) | PH3(fosfan) | H2S (sulfan) |
| GaH3 (gallan) = hydrid! | GeH4 (german) | AsH3(arsan) | H2Se (selan) |
| InH3 (indan) = hydrid! | SnH4 (stannan) | SbH3(stiban) | H2Te (tellan) |
| TlH3 (thalan) = hydrid! | PbH4 (plumban) | BiH3(bisman) | H2Po (polan) |
= sloučeniny čtvyřvazného uhlíku s jinými prvky, většinou kovy (ne s vodíkem a jinými uhlíky!)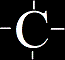
většinou jsou velice reaktivní a s vodou dávají vzniknout základním organických uhlovodíkům.
Příklad: Karbid vápníku (CaC2), karbid hlinitý (Al4C3), ...
= to je něco podobného jako předchozí, jsou to 2 uhlíky spojené trojnou vazbou 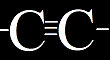
Reaktivita je stejná jako u předchozího a výsledek je podobný
Příklad: dikarbid vápenatý (Ca(C2)),...
= sloučeniny obsahující amidovou skupinu NH2-, jsou odvozeny od amoniaku odštěpením jednoho vodíku.
= sloučeniny obsahující amidovou skupinu NH-II, jsou odvozeny od amoniaku odštěpením dvou vodíků.
= sloučeniny obsahující amidovou skupinu N-III, jsou odvozeny od amoniaku odštěpením všech vodíků.
= sloučeniny odvozené od kyseliny azidovodíkové HN3 odštěpením jednoho vodíku.
= vodné roztoky halogenkyselin (HCl (aq) = kyselina chlorovodíková, HCl = chlorovodík), chalkogenvodíků (H2S (aq) = sulfan)


= kyseliny, které obsahují více než 1 atom prvku X se stejným oxidačním číslem
Příklad: kyselina dichromová (H2Cr2O7), ...
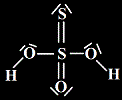
= kyseliny, u nichž je minimálně jeden z atomů kyslíku nahrazen atomem síry (ale pořád má oxidační stav -II !).
Příklad: kyselina thiosírová (H2SO3S → H2S2O3), ...

= kyseliny, které mají jeden z oxidických kyslíků nahrazen peroxoskupinou => stejné oxidační číslo, ale o 1 kyslík navíc!
Příklad: kyselina peroxosírová (H2SO3O2 → H2SO5)
= odvození aniontu od příslušné kyseliny a přidáním koncovky -id (chlorid, bromid, jodid, ...) a k tomu název kationtu.
= odvození názvu pomocí tabulky koncovek.
- Odštěpením všech vodků kyseliny dostaneme název bezvodíkové soli, pokud ale v molekule zůstane nějaký vodík, přidává se před název latinská číselná předpona (di-, tri- ,tetra-, ...; pozn.: předpona mono- se nepoužívá) a k ní slovo hydrogen a následuje název soli.
Příklad: dusičnan sodný (NaNO3), hydrogenuhličitan draselný (KHCO3), dihydrogenfosforečnan lithný (LiH2PO4)
= soli kyselin, které obsahují dva různé kationty (nebo anionty).
V názvu se příslušné ionty seřazují následnovně (oddělují se pomlčkou):
Komplexní sloučeniny mají své specifické názvosloví. Jsou to látky, které mají koordinačně-kovalentní vazby (viz typy vazeb). Existuje sled pravidel tvoření názvu sloučeniny:
Příklad: Hexakyanoželezitanový anion ([Fe(CN)6]3-), dichlorodiaquaplatina ([Pt(Cl)2(H2O)2]), tetraaminměďnatý kation ([Cu(NH3)4]2+), kyselina dibromotrichloroaquakobaltitá (H3[CoBr2Cl3(H2O)]), ...
| Anion/molekula | Obecný název | Název pro ligand | Anion/molekula | Obecný název | Název pro ligand | |
| NH3 | amoniak | ammin- | H2O | voda | aqua- | |
| N3 | azidový anion | azido- | N2 | dusík | dinitro- | |
S22-| disulfidový anion | disulfido- | F- | fluoridový anion | fluoro- | | |
| PO43- | fosforečnanový anion | fosfato- | PO3+ | fosforylový anion | fosforyl- | |
| H- | hydridový anion | hydrido- | OH- | hydroxidový anion | hydroxo- | |
| Cl- | chloridový anion | chloro- | I- | jodidový anion | jodo- | |
| CO32- | uhličitanový anion | karbonato- | CO | oxid uhličitý | karbonyl- | |
| CN- | kyanidový anion | kyano- | NO3- | dusičnanový anion | nitrato- | |
| N3- | nitridový anion | nitrido- | NO2- | dusitanový anion | nitro- | |
| NO2+ | nitryl | nitrilo- | NO | oxid dusnatý | nitrosyl- | |
| O2- | oxid | oxo- | O22- | peroxid | peroxo- | |
| SO42- | síranový anion | sulfato- | SO32- | siřičitanový anion | sulfito- | |
| SO2+ | sulfuryl | sulfuryl- | S2- | sulfid | thio- | |
| NSO+ | thionyl | thionyl- | SCN- | thiokyanatanový a. | thiokyanato- |
Pro procvičení názvosloví vřele doporučuji tyto stránky gymnázia Františka X. Šaldy, kde si lze sestavovat různé obtížnosti názvosloví a tvorby vzorců. Vyskytuje se tam pár chyb, ale v podstatě je to velice kvalitní učební pomůcka.